干货 | 化学原料药变更分类及研究要求

药品某一项变更往往不是独立发生的,一项变更伴随或引发其他变更称之为关联变更。由于这些变更对药品安全性、有效性和质量可控性影响程度可能不同,研究工作总体上应按照技术要求较高的变更类别进行,同时建议关注多项关联变更对药品安全性、有效性和质量可控性产生的叠加影响。
作者此文重点对化学原料药变更的分类以及研究要求进行梳理,方便大家对比学习,赶快收藏起来吧!
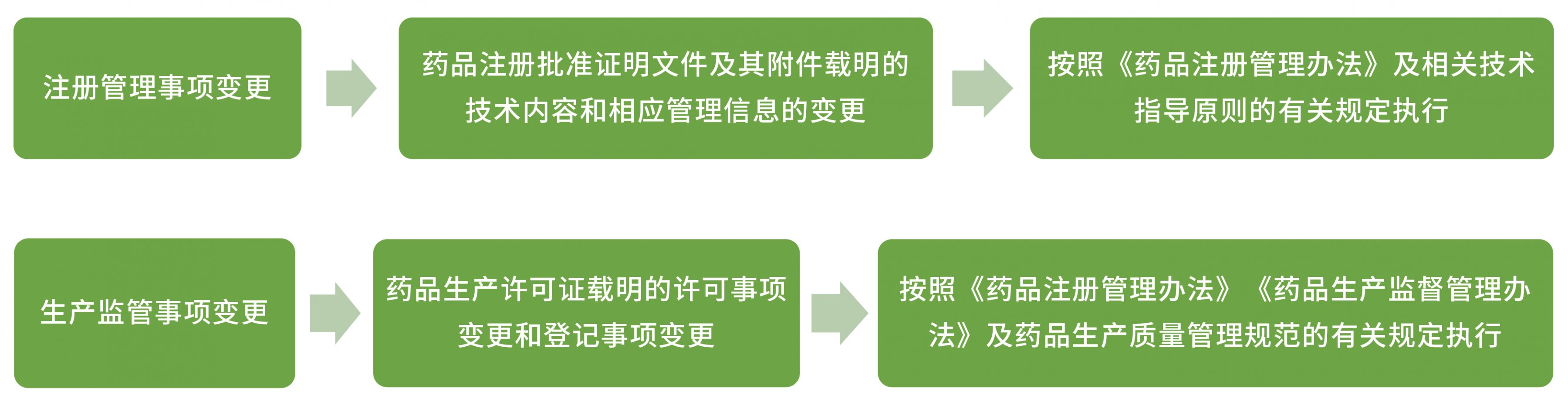
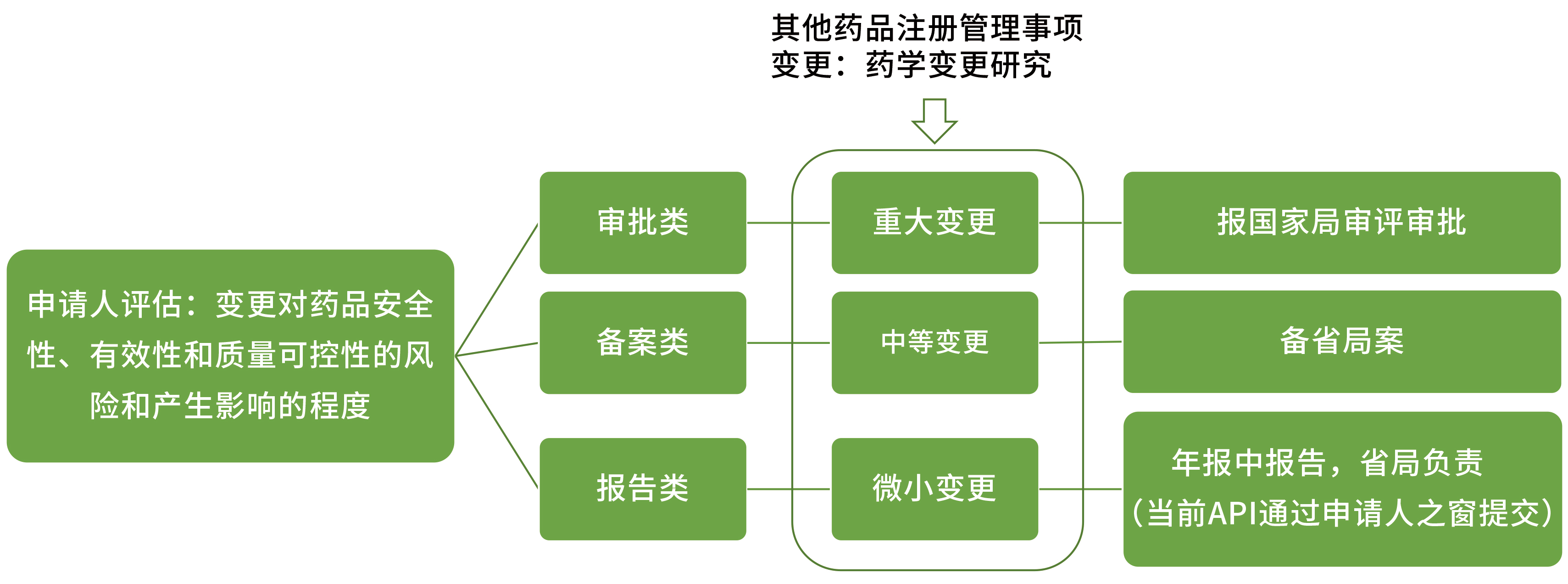
药品上市后变更包括注册管理事项变更和生产监管事项变更,也就是涉及注册批件和生产许可证相关事项的变更。依据变更对药品安全性、有效性和质量可控性的风险和产生影响的程度,将变更划分为审评类变更,备案类变更和报告类变更。
我们常说的药学变更研究,一般都是针对注册管理事项发起的变更。本文对原料药的药学变更分类和研究进行简单的介绍。
-
上市后变更:参照《药品上市后变更管理办法(试行)》、《已上市化学药品药学变更研究技术指导原则(试行)》进行研究。
-
审评期间变更:参照《药品注册申请审评期间变更工作程序》,审评期间允许进行变更申请,这也是近期变更研究的热门话题,审评期间的变更需要注意以下方面:
-
不影响产品质量
-
仅能提出一次
-
参照已上市药品变更相关指导原则研究及申请
-
时限按变更/原申报剩余时间最长计算
-
审评期间的变更以补充申请报CDE
-
状态为I,未进入审评的原料药变更:可参照已上市药品变更研究,当前原料药受理后即视为启动审评,暂时没有途径递交资料,后续CDE应该会有新的政策出来。
依据变更对药品安全性、有效性、质量可控性的影响,将药学变更分为微小变更、中等变更和重大变更,由申请人依据对产品的理解进行评估及相应的研究、申报工作。
变更研究
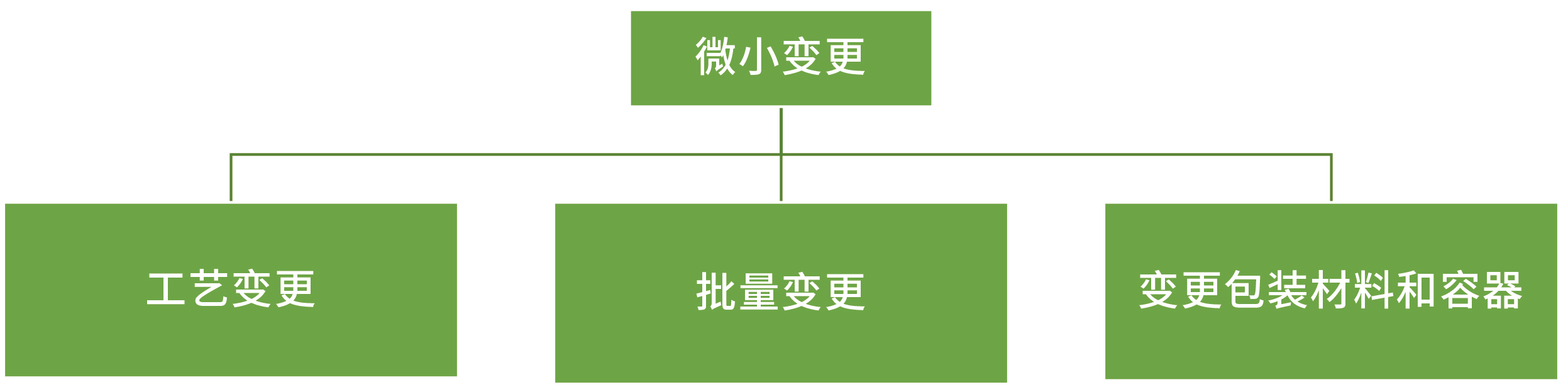
微小变更:
-
工艺变更:
-
增加/收严过程控制;
-
提高起始原料、中间体的质量标准;
-
变更试剂、溶剂的质量标准或级别,但不降低质量;
-
变更最后一步反应之前生产设备;
-
变更最后一步生产设备,且材质、设计和工作原理不变,原料药关键质量不变;
-
变更起始原料的供应商,起始原料的合成路线不变,且起始原料的质量不降低。
研究内容:
-
变更情况及原因;
-
一批样品检验;
-
年报中报告首批样品的长期稳定性试验数据。
-
批量变更:生产批量变更在原批准批量的10倍以内(包括10倍)
研究内容:
-
设备对比;
-
一批批生产记录;
-
变更前后质量对比研究;
-
对 1-3 批样品进行检验。
-
变更包装材料和容器:
-
变更原料药装量;
-
固体原料药的包材(包材为A)。
研究内容:变更前后包材对比。
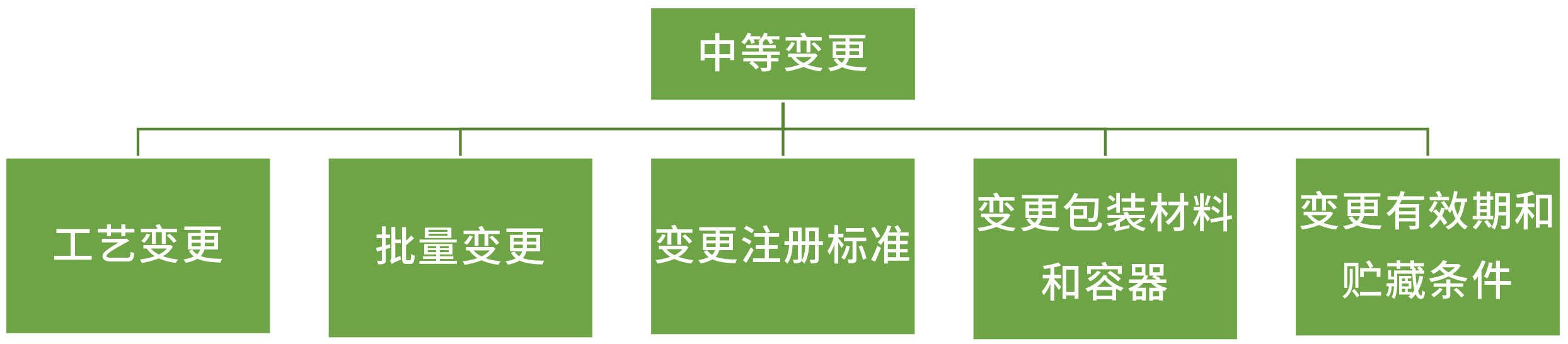
中等变更:
-
工艺变更:
-
延长工艺路线,且延长的工艺路线与原起始原料一致;
-
变更起始原料的合成路线,起始原料的质量不降低;
-
变更最后一步反应之前的工艺步骤中的反应试剂、溶剂种类、生产条件等,但原料药杂质谱保持一致;
-
将返工工艺作为固定的生产步骤纳入注册生产工艺;
-
变更起始原料、中间体的质量标准,变更后起始原料、中间体的质量控制水平不得降低;
-
变更起始原料的供应商,起始原料的合成路线不变,且起始原料的质量不降低;
-
无菌原料药变更除菌过滤过程的滤过参数/除菌工艺过滤器从单一过滤器改为两个无菌级过滤器串联。
研究内容:
-
变更情况及原因;
-
一批批生产记录;
-
质量对比研究,变更前后样品的杂质谱等一致;
-
1-3 批样品进行检验;
-
一批样品加速及长期稳定性考察,提供 3 个月的稳定性研究资料。
-
批量变更:生产批量变更在原批准批量的10倍以上。
研究内容:设备及工艺对比。
-
变更注册标准:
-
新增检验项目;
-
在原标准规定范围内收紧限度;
-
注册标准中文字描述的变更。
研究内容:
-
对质量标准变更合理性进行研究;
-
不用提供生产记录及稳定性数据;
-
多批次检测数据。
-
变更包装材料和容器:无菌和/或液体原料药的包装材料和容器的材质和/或类型。
研究内容:
-
变更前后包材对比;
-
进行包装工艺验证(不要求全工艺验证)。
-
变更有效期和贮藏条件:
-
延长药品有效期;
-
缩短药品有效期。
研究内容:
-
变更情况及原因;
-
3 批样品长期稳定性数据。
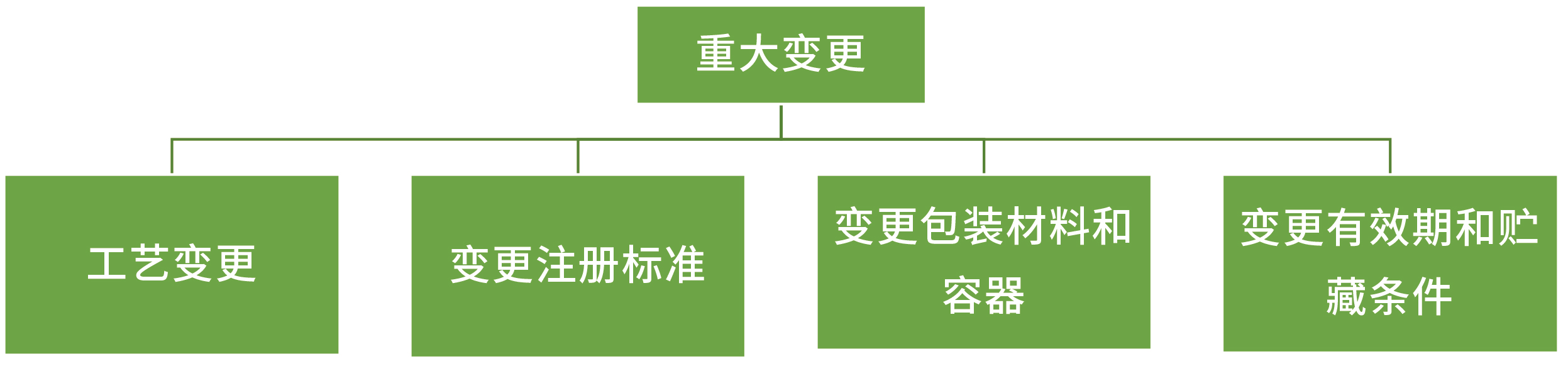
重大变更:
-
工艺变更:
-
变更原料药合成路线(除路线延长);
-
变更起始原料的合成路线,起始原料的质量发生变化;
-
变更最后一步反应及之后的生产工艺;
-
变更可能影响原料药关键质量属性的工艺参数;
-
在注册生产工艺中增加重新加工工艺;
-
放宽或删除已批准的起始原料、中间体质量控制和生产过程控制;
-
变更原料药生产工艺中的设备,可能导致原料药杂质谱或关键理化性质发生变化;
-
无菌原料药生产过程变更灭菌/无菌工艺,变更除菌过滤器孔径;
-
其他可能导致原料药杂质谱和关键理化性质与变更前不一致的变更。
研究内容:
-
变更情况及原因;
-
变更后的API和中间体结构确证;
-
一批批生产记录;
-
质量对比研究;
-
3 批样品检验;
-
三批样品加速及长期稳定性考察,3~6个月的稳定性对比研究。
-
变更注册标准:
-
变更检验方法;
-
放宽控制限度;
-
删除注册标准中的任何项目。
研究内容:
-
对质量标准变更合理性进行研究;
-
3批样品检测数据;
-
变更包装材料和容器:
-
变更为全新材料、全新结构、风险度提高的新用途的包装材料和容器;
-
变更纳入登记管理的包装材料和容器,变更后的包装材料和容器尚未登记或登记状态为I。
研究内容:
-
变更前后包材对比;
-
进行包装工艺验证(不要求全工艺验证)。
-
变更有效期和贮藏条件:
-
变更药品贮藏条件;
-
由于药品的其他变更导致的有效期变更。
研究内容:
-
变更情况及原因;
-
按方案,3 批样品稳定性,3-6月数据。
除以上变更外,《药品上市后变更管理办法(试行)》及《已上市化学药品药学变更研究技术指导原则(试行)》对持有人及生产场地的变更流程及研究内容进行了明确的规定。
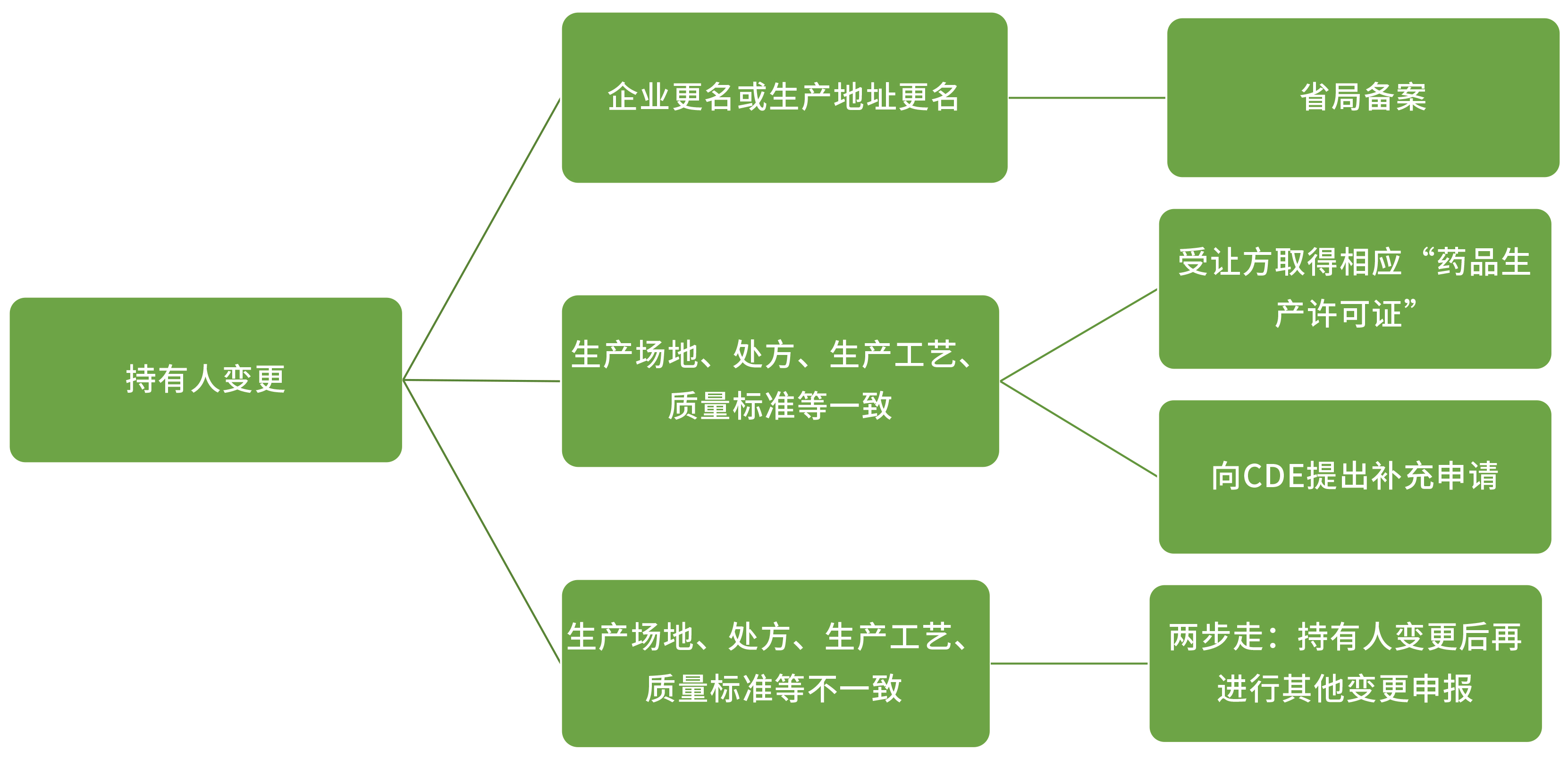
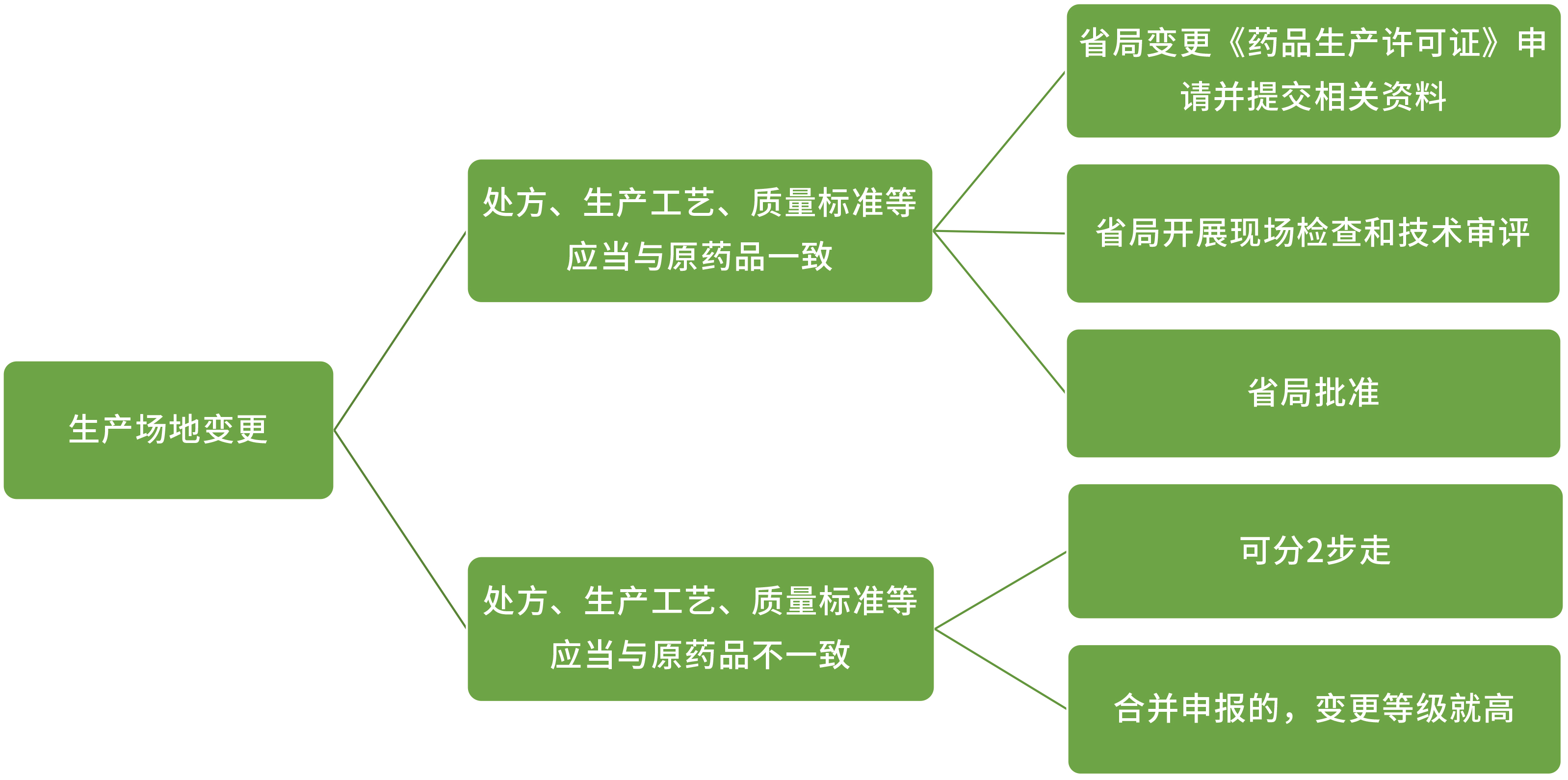
-
在同一生产地址内变更非无菌生产步骤:
研究内容:
-
变更的具体情况和原因;
-
比较新旧场地生产工艺情况(含设备和工艺);
-
对变更后一批样品进行检验,应符合质量标准规定;
-
对变更后首批样品进行长期稳定性考察,并在年报中报告。
上报:省局
-
在同一生产地址内变更无菌步骤 OR 生产地址变更至另一不同生产地址:
研究内容:
-
变更的具体情况和原因,进行验证;
-
比较新旧场地生产工艺情况(含设备和工艺);
-
变更后一批样品的批生产记录;
-
进行质量对比研究,关键理化性质和 杂质谱等应保持一致;
-
对变更后三批样品进行检验;
-
变更后一批样品进行加速及长期稳定性考察,提供3个月的稳定性研究资料,并与变更前产品比较,变更后样品的稳定性应不低于变更前。
上报:省局
案例:某原料药,由于起始原料供应商不再供货,对生产工艺的进一步研究及制剂对原料药质量要求的提高,拟进行一系列变更:
起始原料变更:

工艺优化:

T项目注册标准变更:

解析:案例该项目涉及一系列变更,有属于微小变更的改变后处理溶剂,中等变更的收严限度,重大变更的变更最后一步反应参数等,依据 《已上市化学药品药学变更研究技术指导原则(试行)》,按照技术要求较高的类别进行研究,故本品按重大变更进行研究,报补充申请,并依据具体变更内容进行针对性研究。需要研究内容如下:
-
对变更前后的路线进行详细的对比说明
-
对变更前后的起始物料、中间体、原料药进行对比研究
-
进行工艺参数评估,拟定合理参数范围
-
对变更后生产的原料药进行结构确证
-
进行三批工艺验证,对所得中间体和原料药进行全面分析研究,提供3批检测报告
-
对变更后三批样品进行加速及长期稳定性考察,提供3-6个月的稳定性研究资料

主要法律依据:
《中华人民共和国药品管理法》.2019.8
《药品生产质量管理规范(2010年修订)》.2010.10
《药品注册管理办法》.2020.3
《药品上市后变更管理办法(试行)》.2021.1
《已上市化学药品药学变更研究技术指导原则(试行)》.2021.2
《已上市化学药品变更事项及申报资料要求》.2021.2
《药品生产场地变更研究技术指导原则(征求意见稿)》.2017.10
《药品注册申请审评期间变更工作程序》.2021.6
创新药(化学药)临床试验期间药学变更技术指导原则(试行).2021.3
-END-
关于我们:
北京新领先成立于2005年,注册资金近亿元,于2015年实现上交所上市(股票代码:600222),是一家面向全球提供药学临床前研究、临床 CRO 和CDMO服务的高新技术企业,连续多年被评为“中国医药研发公司10强(2019年位列第一)”。
目前,公司已与国内外上下游500余家企业建立合作关系,其中部分企业为战略合作关系。累计承接了药学研发项目400余项、临床研究项目500余项,申请专利200余项,获得授权近百项。
公司从建立伊始就以“是我,让中国新药技术和生产工艺与世界同步”作为企业愿景,致力于用创新的研发和服务模式以及信息化技术推动中国医药产业发展,缩小与世界先进水平间的差距,让中国人民早日用上安全药和良心药!
公司总部位于北京中关村高新技术园区,拥有10000平米研发实验室,同时在郑州临空生物园区建立了新药筛选及检测平台、药物评价平台(动物房,GLP、AAALAC、CNAS 认证)、大分子中试及大规模生产服务平台、小分子 CMC 制剂研究生产平台、细胞技术服务平台和临床CRO平台等六大符合国际标准(FDA、EMA 和 NMPA GMP 标准)的研发平台,形成“新领先 CXO”全产业链服务体系。仿创结合,双引擎驱动,能够为客户提供药学研发全生命周期的多元化服务。


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
