“概念验证”很重要,把它们放到早期临床试验中去——浅谈POC研究
2020年6月24日,国家药品监督管理局药品审评中心公布了《化学药品改良型新药临床试验技术指导原则(征求意见稿)》,不到5000字的内容,却蕴含巨大的信息量。
其中,大家有没有注意到“概念验证”这个词?一共出现了3次:
1、因此,化药改良新药的临床研发可借鉴已上市药品的临床开发经验,立足于明确的临床需求——如现有已上市药品疗效待提高、毒性待改善或给药方式待优化等,进行优化。开展必要的临床试验,通常在临床试验中对临床优势进行概念验证,并最终确证。
2、部分化药改良新药可能具备探索新适应症的潜力。如通过优化结构、剂型或改变给药方式等途径开发新适应症,可借鉴已上市药品的临床试验数据,对结构或靶点已知的毒性进行风险控制,适当简化早期剂量探索试验,从探索新适应症的概念验证试验时,则应遵照创新药研发的一般规律,逐步递进以证实获益。
3、以改善现有药物安全性为目的的化药改良新药,首先应明确待改善的不良反应发生机制——是与化药活性成分单体的脱靶毒性或某毒性代谢产物相关,与原制剂的组织分布和药代动力学特征相关,还是与处方中的某辅料相关;并在非临床研究中对相关机制进行研究,在临床试验中对安全性优势进行概念验证。
指导原则要会看,里面可是字字珠玑,绝无啰嗦!
这里的“概念验证”也不是一个虚词,而是实打实的一种试验类型,根据chictr.org.cn数据库搜寻结果,发现这种类型的试验也只有5项:
【登记号】试验题目
【CTR20200049】HTD1801对成年PSC患者的有效性与安全性的POC和剂量探索性研究;
【ChiCTR1900024869】奥马珠单抗治疗荨麻疹性血管炎疗效及疗效预测指标的研究;
【ChiCTR1900021742】个体化辅助(免疫)疗法在原发可切除性胰腺癌中的概念验证研究;
【ChiCTR1800018620】特立帕肽(甲状旁腺激素,PTH(1-34))治疗骨质疏松伴腰椎间盘退变腰痛患者的Ⅳ期多中心随机双盲安慰剂对照概念验证性临床试验方案;
【ChiCTR-INR-17011425】常规抗精神病药物治疗合并低剂量电抽搐疗法(Low-doseElectroconvulsivetherapy,LECT)对精神分裂症患者的疗效、认知损害的先行性概念验证性试验。
既然指南明确了应该开展,而实际开展的又那么少,这里的GAP就该有人填补。今天的任务就是填补大坑,为日后开展“概念验证性试验”,先铺一些认知上的路。
一、“概念验证”的开端,还是为了省钱
90年代之前的研发思路:使用疾病动物模型筛选具有活性的新化合物实体、天然化合物,然而这种模式存在明显的弊端,动物模型常常不能准确预测人体内的疗效,所以就有企业将研发思路转到靶位开发上去,再根据靶位点来设计、筛选和优化新化合物实体,最终推出新药。
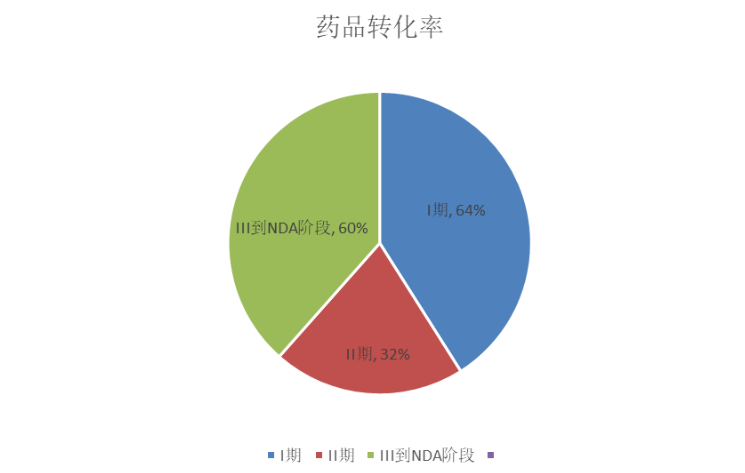
策略初期优势非常明显,上个世纪末很多明星产品都靠这种思路研发成功,2000年后,这种模式的瓶颈开始显现,导致新化合物上市速度减慢,失败率增加。有数据显示,不同阶段试验数量到药物上市的转换率有如下趋势:

数据分析结果可知,大部分新化合物停滞在II期试验上,其主要原因是药物的有效性。II期的失败当然意味着之前的人力和资金的投入都付之东流,故基于降低成本和控制风险的考虑,必须减少开发无效候选药物。
二、如何降低开发风险?
机制验证POM(proof of mechanism):是通过试验使药物的药理效应可以安全地在人体中表现出来。它强调的是人体,而不是过去在研发早期所用的动物模型。
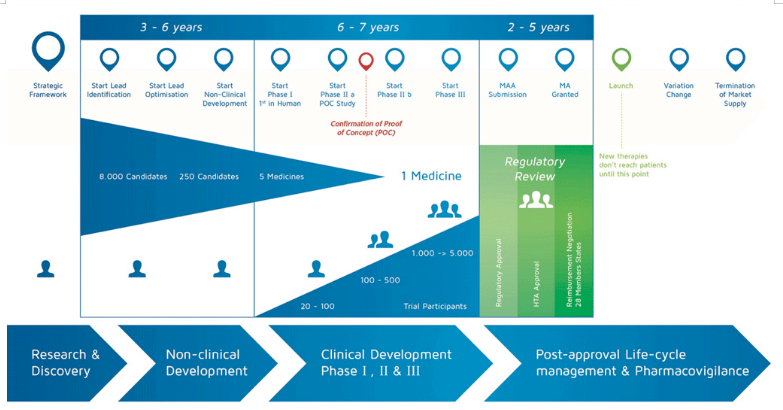
概念验证POC(proof of concept):是指验证候选药物的药理效应可以转化成临床获益,一般在早期临床研究阶段进行(通常它们被放在II期研究中),可以独立进行,如下图所示:
临床中的疗效是药理效应的长时间作用和累加的结果,在一个靶点上产生的药理效应并不一定就能够转化成临床方面的治疗效果。例如某药确实能抑制某疾病代谢途径中的关键一步,但疾病所涉及的代谢途径通常不是一条,还有代谢旁路存在,所以对某一途径关键步骤的抑制,并不一定能带来所期望的临床效益。
虽然国外有文献报道说1/3的新化合物实体在I期完成了POC确认,2/3在II期完成POC确认,极少数在III期完成。但从文初我们在国内临床试验数据库当中的搜索结果看,POC至少在国内还鲜有人再做,却又是一种趋势,因为这一策略可以降低成本控制风险,同时也被NMPA所推荐。
大多数的POC在IIa期完成,这是因为此时已有一些临床研究的结果可供参考。此时,在进行研究设计时,最简单的方法是选择一个剂量(最大耐受剂量,MTD)和一个安慰剂进行比对研究。在MTD剂量下,如果不能观察到药物疗效信号(POC阴性),通常情况下,低于MTD剂量也观察不到疗效(U型量效关系曲线除外),继续试验的风险极高;反之,如果能看到一些符合标准的药效学信号(POC阳性),继续研究就有了可能,并可在很大程度上有获得批准上市的可能。
三、POC试验设计
IIa期开展POC试验时,首先选择合适的疾病患者,他们最要具有明确的分子靶位。靶位的选择应当考虑3个因素:
a. 每种疾病受多个gene和环境因素的影响,但靶点常常只有1个,且药物的活性是调谐靶位的下游途径;
b. 药效与疾病途径异常程度呈现比例关系;
c. 在某一药物暴露剂量下,这些患者群体应该是均一的,以便在较小的群体中尽快获得阳性结果,此外,也可以用富集法“获取”具有药物作用靶位的患者。
而设计上,对疗效终点的选择,尽量选择变异度低的指标,这通常意味着可以入选较少的患者;另外指标应答较为快速,通常应小于等于4周。所以,POC所选择终点常常是与临床疗效,具有中、高度关联性的生物标志物,这样可以加快试验进度。
荷兰临床药理学家Cohen曾对候选药物是否继续开展试验的决策问题,总结出3大决策基石:
1. 药物在靶位的暴露水平;
2. 药物对靶位的占领水平;
3. 药物作用于靶点后出现的功能性作用。
他认为如果满足这3点,则该候选药物开发成功的机率最高。以上这3点,1和2如果出现,相当于POM阳性,如果3的情况发生,相当于是POC阳性信号。
四、似曾相识的感觉?POM/POC和PK/PD的关系
药物研发当中的各种专有名词,缩写满天飞,仔细看有些术语也有重叠的地方,或者就是某一名词的子集。
对于POM,POC研究来说,他们有点类似于临床早期阶段的PK/PD研究,或者你将其理解为PK/PD研究的一部分也不错。当然,子集和母集也是有区别的。POM选择的生物标记物主要和候选分子的作用机制相关;POC研究选择与临床疗效有关的下游生物标志物作为指标。另外,PK/PD研究可以进行建模和模拟的方法进行,而POM,POC通常都是实打实的研究,不做建模和模拟。凡事有例外,我们在下面就会看到反例。
五、举3个真实的栗子
例1:PD-1项目
在该项目的I期研究中,我们设计的POM研究包括外周血CD8+ T细胞表面PD-1受体占有率, IL-2、 IL-4、IL-6、IFN-γ和TNFa等生物标记物;在MTD剂量确定后,我们采用MHC-I,PD-L1,TIL,MSH-I/dMMR,以及EBV、HPV、MCV、HBV/HCV感染情况等指标进行POC的研究,以增加研究的风险可控性。
例2:其次,我们来看一个早期看起来很美,最终却失败的栗子。
ASK8007是针对“骨桥蛋白”Oseopotin开发的人源化单克隆抗体,骨桥蛋白被认为是与RA发病机制有关的靶点。在ASK8007的FIH研究中,除安全性、耐受性、PK研究外,研究者发现体内骨桥蛋白-ASK8007复合物的含量与剂量呈现比例关系,即POM阳性。但随后在患者开展的POC研究中,以常用的RA疗效指标进行观察,则发现该药与安慰剂组无显著性差异,POC结果阴性。也就是说骨桥蛋白作为RA的治疗新靶点可能存在问题。
例3:最后,要举一个最近的、成功的栗子
近期ABBV公布的一项M16-560的IIa期概念性验证研究,它评估ABBV-3373相比对照药Humira(阿达木单抗)对MTX应答不足的中重度RA患者的安全性、耐受性、药动学和疗效。该研究采用的概念验证指标是DAS28-CRP,评定时间是12周(稍长,但符合RA的临床疗效指标特点),该研究还有一个显著的特点,就是打破了POM和POC不采用模拟/虚拟研究的惯例,他们在设计上选用了阿达木单抗历史数据来补充此次阿达木单抗的试验数据,再与ABBV-3373进行比较分析。这在设计上采用了虚实结合的方法,节省了样本和时间。根据这个研究推测,今后的临床试验,历史数据,虚拟数据,甚至模拟的方法也可以在POC研究中应用。
参考文献:
01.http://www.cde.org.cn/news.do?method=viewInfoCommon&id=bdcf2b9693e63dbe
02.Chen C . Opportunities and pitfalls in clinical proof-of-concept: principles and examples[J]. Drug Discovery Today, 2018, 23(4).
03.Cohen A. Pharmacokinetic and Pharmacodynamic Data to be Derived from Early-Phase Drug Development: Designing Informative Human Pharmacology Studies[J]. Clinical Pharmacokinetics, 2008, 47(6):373-381.
04.魏敏吉, 赵德恒. 新药早期临床研究的推进思路——从机制验证到概念验证[J]. 中国新药杂志, 2015(11):75-80.
05.Jill A M , Lewis R E , Brüggemann Roger J M, et al. Preclinical Safety, Tolerability, Pharmacokinetics, Pharmacodynamics, and Antifungal Activity of Liposomal Amphotericin B[J]. Clinical Infectious Diseases, 2019(Supplement_4):Supplement_4.
06.https://seekingalpha.com/news/3581870-abbvie-adc-shows-positive-action-in-rheumatoid-arthritis-study
07.https://clinicaltrials.gov/ct2/show/NCT03823391
关于我们
深蓝海(郑州)生物医药是北京新领先在临床CRO领域打造的一个知名品牌。公司拥有300余人高专业水准的临床服务团队,并在石家庄、武汉、长沙、杭州、郑州、沈阳、大连、广州等20多个中心城市设立驻地办事处。公司下设医学部、临床运营部、数据部、质量控制委员会、药物警戒部、注册部和人类遗传资源管理委员会等部门。能够通过创新的服务模式和多维的信息化技术,推动临床研究的发展及临床研究外包服务模式的变革,为客户提供多元化的研发支持和服务,包括创新药和仿制药的Ⅰ~Ⅳ期临床试验、仿制药生物等效性(BE)试验及药代动力学(PK/PD)临床研究、体内外相关性研究(IVIVR)、医疗器械临床研究及第三方稽查等,全面覆盖大小分子药物,满足不同类型企业的临床研究需求,为国内外客户打通新药上市前最关键的瓶颈。
目前,公司已经与国内28个省市的400多家GCP医院建立了合作,并与其中80余家医院有5年以上合作关系,如北京大学第一医院、北京安贞医院、北京阜外心血管医院、上海长海医院、复旦大学附属中山医院、江苏省人民医院、吉林大学中日联谊医院、哈尔滨医科大学附属第一医院、广东中医院、天津中医药大学附属第一医院等。
转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hot line:010-61006450
Hot line:010-61006450
 EN
EN
 010-61006450
010-61006450 Address:
Address: Marketing Department:
Marketing Department: Leadingpharm
Leadingpharm Pharm News
Pharm News 010-61006450
010-61006450
