政策法规 || 《化学药物残留溶剂的风险评估和控制的共性问题(征求意见稿)》(附法规概览1.19-1.23)
01
关于公开征求《化学药物残留溶剂的风险评估和控制的共性问题(征求意见稿)》意见的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/ac589f93f46056151fdf1b037788f4ad
02
关于公开征求ICH《E22:患者偏好研究的一般考虑》指导原则草案意见的通知

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/9a9c3213a4f44e502bf7b18bbe93333d
03
关于公开征求《局部起效化学仿制药物理化学及结构(Q3)特性研究技术指导原则(征求意见稿)》意见的通知
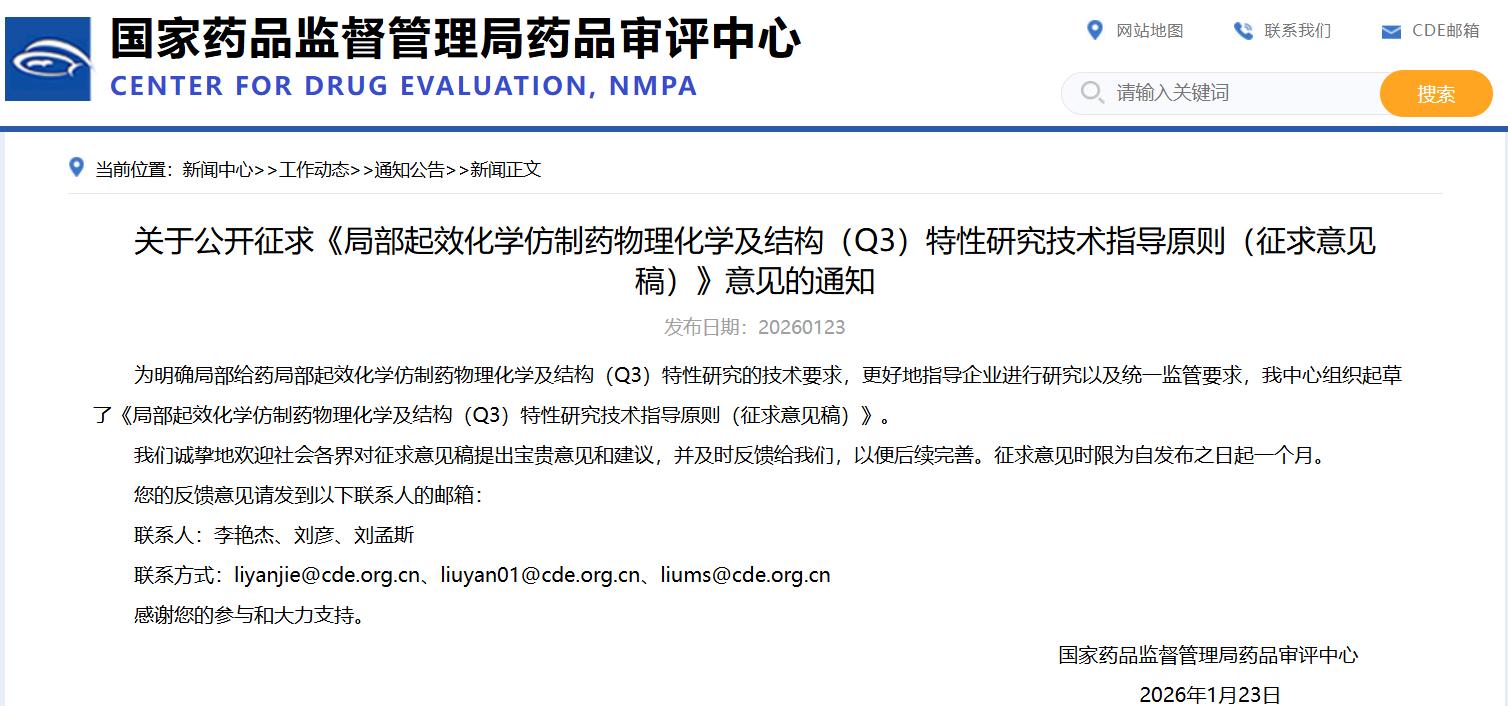
点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/38c7c506185f3f4090ff07f8934e835b
04
国家药监局药审中心关于发布《预防用疫苗佐剂药学研究技术指导原则(试行)》的通告(2026年第7号)

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/c21b81148b9b7908d172f97bf467d133
01
国家药监局关于适用《Q8、Q9和Q10问答(R5)》国际人用药品注册技术协调会指导原则的公告(2026年第9号)

点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20260119085720172.html
02
中药保护品种公告(第34号)(2026年第11号)
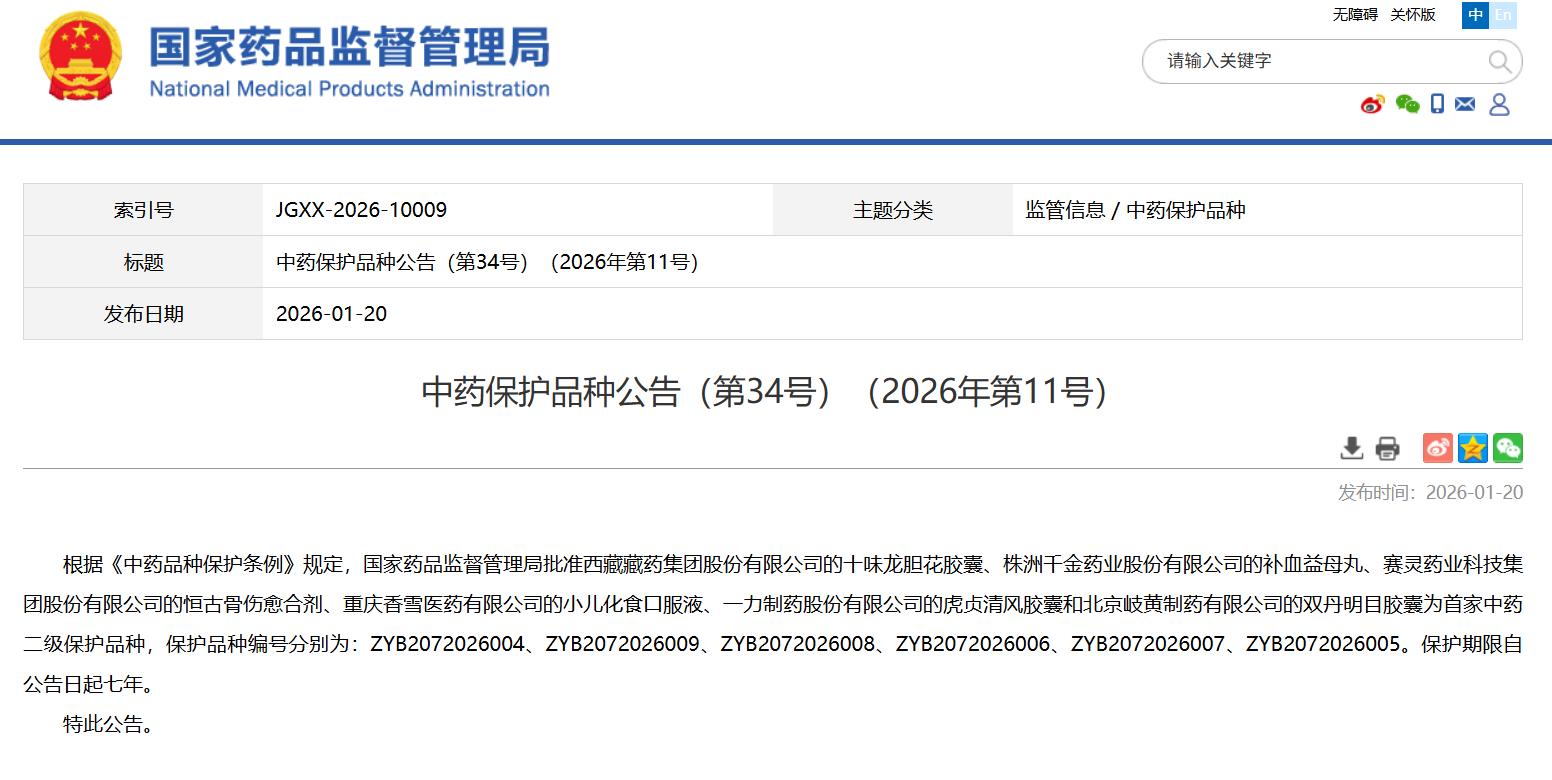
点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/zhybhpzh/zhybhpzhgg/20260120085142173.html
03
国家药监局关于45批次不符合规定化妆品的通告(2026年第2号)

点击下方链接
查看详细信息
https://www.nmpa.gov.cn/xxgk/ggtg/hzhpggtg/hzhpchjgg/hzhpcjgjj/20260120173328152.html
04
2026年1月23日中药品种保护受理公示

点击下方链接
查看详细信息
https://www.nmpa.gov.cn/zwfw/zwfwgggs/zypzbhslgs/20260123143707128.html
01
国家药监局药审中心关于发布《药物临床试验中应用贝叶斯外部信息借用方法的指导原则(试行)》的通告(2026年第6号)

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/1b87c172f248c6eb876ea2b9d93c4d1e
02
关于将依维莫司微片纳入《儿童抗肿瘤药物研发鼓励试点计划(星光计划)》试点项目的公示

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/3c3ef49a5ab316a8d6ca95850b325dbb
03
关于将盐酸匹米替尼胶囊纳入《儿童抗肿瘤药物研发鼓励试点计划(星光计划)》试点项目的公示

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/3dda22a2276c2601a3c797f7800ecf24
04
关于将ONC201胶囊纳入《儿童抗肿瘤药物研发鼓励试点计划(星光计划)》试点项目的公示

点击下方链接
查看详细信息
https://www.cde.org.cn/main/news/viewInfoCommon/27cae5f5c6ee99cacdf0d86bc4bdb06b
01
近期,药典委发布的标准草案公示如下:
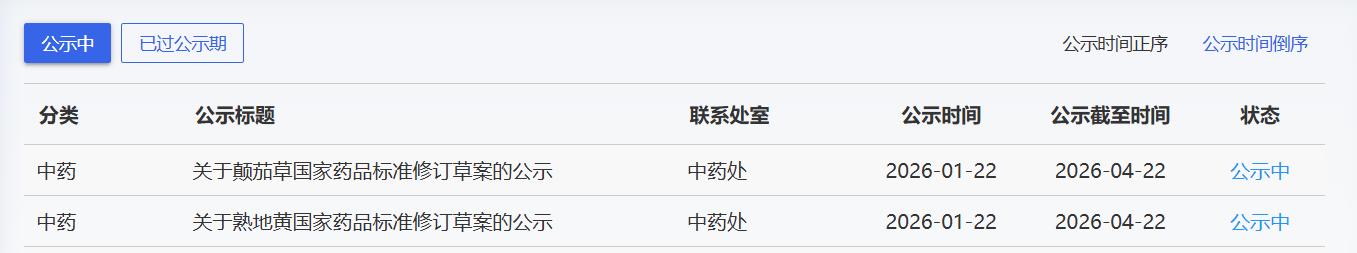
点击下方链接
查看详细信息
https://www.chp.org.cn/#/business/standard
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-83057670
Hotline服务热线:010-83057670
 简体中文
简体中文

 010-83057670
010-83057670 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
