收藏 | 特医食品注册申报的那些事
特医食品区别于普通食品,是可以满足特定人群或特定疾病病人的特殊膳食需求的食品,包括适用于0月龄至12月龄的特殊医学用途婴儿配方食品和适用于1岁以上人群的特殊医学用途配方食品。本文针对特医食品注册申报相关信息进行汇总。
注册申请人应当为以下两种情况:
-
拟在境内生产并销售特殊医学用途配方食品的生产企业
-
拟向境内出口特殊医学用途配方食品的境外生产企业
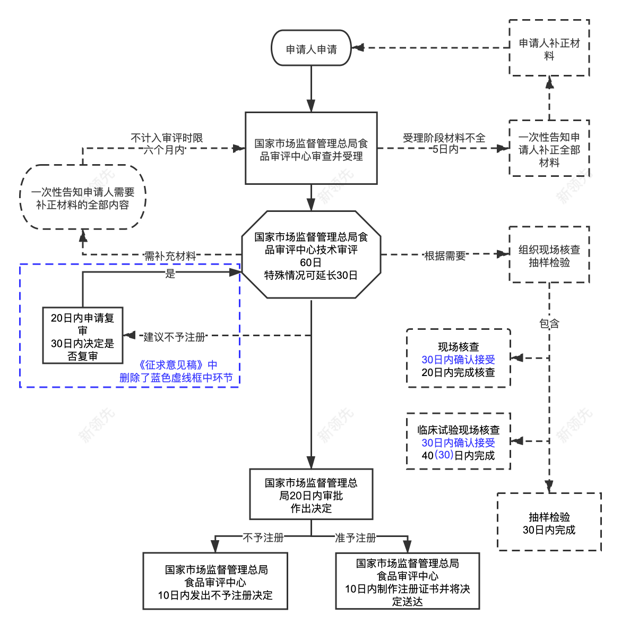

▲ 特医食品申报流程图表
❖ 优先审评审批程序
✎ 适用范围:
-
罕见病类特殊医学用途配方食品
-
临床急需且尚未批准过的新类型特殊医学用途配方食品
-
国家市场监督管理总局规定的其他优先审评审批的情形
✎ 政策支持:
注册前需提前食品审评机构沟通交流,经沟通确认后方可在提出注册申请时,同时提出优先审评审批申请。符合条件的,经公示后纳入优先审评审批程序。注册申请的审评时限缩短到30个工作日,审评机构将优先安排现场核查、抽样检验,经沟通交流确认后,可以补充提交技术材料。
✎ 产品名称包括通用名称、商品名称,申请注册的进口特殊医学用途配方食品还可标注英文名称,英文名称应与中文名称有对应关系。
✎ 通用名称应当反映食品的真实属性(指产品形态、食品分类属性等),使用《食品安全国家标准特殊医学用途婴儿配方食品通则》(GB25596)、《食品安全国家标准特殊医学用途配方食品通则》(GB29922)中规定的分类(类别)名称或者等效名称。
✎ 商品名称应当符合法律、法规、规章和食品安全国家标准的规定,可以采用商标名称、牌号名称等。产品的商品名称不得与已经批准注册的药品、保健食品及特殊医学用途配方食品名称相同。
✎ 其他需要说明的问题:
-
对其他需要说明的问题进行概述;
-
产品曾经不予注册的,对相关情况及原因进行说明。
✎ 产品配方设计及其依据:产品配方设计应该符合相应的《食品安全国家标准》(GB25596或GB29922);特定全营养配方食品和非全营养配方食品注册,应对产品的配方特点、配方原理或营养学特征进行描述或说明。
✎ 产品配方:配方中食品原料、食品辅料、营养强化剂、食品添加剂的种类应符合相应食品安全国家标准和(或)有关规定。
✎ 产品研发报告:对产品研发目的、研发情况和主要研究结果进行概括和总结;特殊医学用途婴儿配方食品和全营养配方食品注册,应按要求提交稳定性研究研究报告。
✎ 生产工艺文本。文本主要内容:详细描述生产工艺步骤,如预处理、投料、制备、灭菌、包装等,提供各工艺步骤技术参数。
✎ 对生产场所和所用设备的说明。如生产车间的洁净度级别、温湿度要求、设备名称和型号等。
✎ 说明影响产品质量的关键环节及质量控制措施。
✎ 不同品种的产品在同一条生产线上生产时,提供有效防止交叉污染所采取的措施及相关材料。
✎ 生产工艺流程图,注明相关技术参数。
✎ 研发能力证明材料。包括:产品配方设计及其依据、产品研发报告等。
✎ 生产能力证明材料:
-
产品已上市的申请人应提交以下材料:已取得食品生产许可证的境内申请人,应提交食品生产许可证复印件(含正本、副本及品种明细);已取得进口资质特殊医学用途配方食品的境外申请人,应提交良好生产管理规范和(或)相应生产质量管理体系的证明材料。
-
产品未上市或未取得生产许可的申请人应提交的材料包括:与产品生产相适应的食品安全管理人员、食品安全专业技术人员基本情况表;生产场所的主要设施、设备清单;申请人按照良好生产管理规范要求建立与所生产食品相适应的生产质量管理体系的相关证明材料。
-
检验能力证明材料。包括:自行检验的,应提交检验人员、检验设备设施、全项目资质的基本情况;不具备自行检验能力的,应提交实施逐批检验的检验机构名称、法定资质证明以及申请人与该检验机构的委托合同等。
✎ 申请特定全营养配方食品注册的,应当按照《特殊医学用途配方食品临床试验质量管理规范(试行)》进行临床试验,并出具临床试验报告。
✎ 产品申请注册时,除临床试验报告外,申请人还需提交临床试验相关材料,包括:国内和(或)国外临床试验材料综述、具有法定资质的食品检验机构出具的试验用产品合格的检验报告、临床试验方案、研究者手册、伦理委员会批准意见、知情同意书模板、数据管理计划及报告、统计分析计划及报告、锁定数据库光盘、其他材料等。
✎ 申请人主体登记证明文件复印件。
✎ 产品含注册商标的,应提供国家商标注册管理部门批准的商标注册证书复印件,商标使用范围应符合要求。商标注册人与申请人不一致的,应提供申请人可以合法使用该商标的证明文件。
✎ 申请进口特殊医学用途配方食品注册,应提交以下证明性文件:(申请人应当确保译本的真实性、准确性与一致性)
-
产品生产国(地区)政府主管部门或者法律服务机构出具的境外申请人为境外生产企业的资质证明文件复印件及其中文译本。
-
产品生产国(地区)政府主管部门或者法律服务机构出具的允许产品上市销售的证明复印件及其中文译本,产品未上市销售的,可不提供。
-
由境外申请人常驻中国代表机构办理注册事务的,应当提交《外国企业常驻中国代表机构登记证》复印件。
-
境外申请人委托境内代理机构办理注册事项的,应当提交经过公证的授权委托书原件及其中文译本,以及受委托的代理机构营业执照复印件。
-
授权委托书中应载明出具单位名称、被委托单位名称、委托申请注册的产品名称、委托事项及授权委托书出具日期。授权委托书的委托方应与申请人名称一致。
✎ 在提交纸质申请材料之前,应先完成电子申请程序:通过国家市场监督管理总局网站或总局食品审评机构网站进入特殊医学用途配方食品注册申请系统填写并打印注册申请书(填写完电子版打印并盖章)。
✎ 同时提交纸质申请材料。
✎ 申请材料一般要求:
-
进入在线申请系统按规定填写并打印注册申请书。
-
在注册申请书后附上相关申请材料,顺序按申请书中列明顺序排列。
-
申请材料首页为材料目录,整套材料需装订成册并有详细目录。
-
每项材料需有封页,封页上应注明产品名称、申请人名称,右上角注明该项材料名称。
-
各项材料之间应当使用明显的区分标志,并标明各项材料名称或该项材料所在目录中的序号。
-
材料使用A4纸完整清楚打印(中文不得小于四号字,英文不得小于12号字),不得有涂改。
-
申请材料应骑缝加盖申请人公章(检验机构出具的报告除外),材料内盖章需加盖在文字处。
-
注意信息一致性。
-
申请中的外文材料应翻译为规范的中文。
-
应同时提交申请原件、复印件和电子版。复印件和电子版的内容应与原件一致。
-
注册申请需提交原件1份、复印件7份;变更、延续注册提交原件1份、复印件7份。
-
电子版上传系统的应是加盖公章后的版本。
-
《特殊医学用途配方食品注册管理办法》2016
-
《特殊医学用途配方食品临床试验质量管理规范(试行)》2016
-
《特殊医学用途配方食品注册生产企业现场核查要点及判断原则(试行)》2016
-
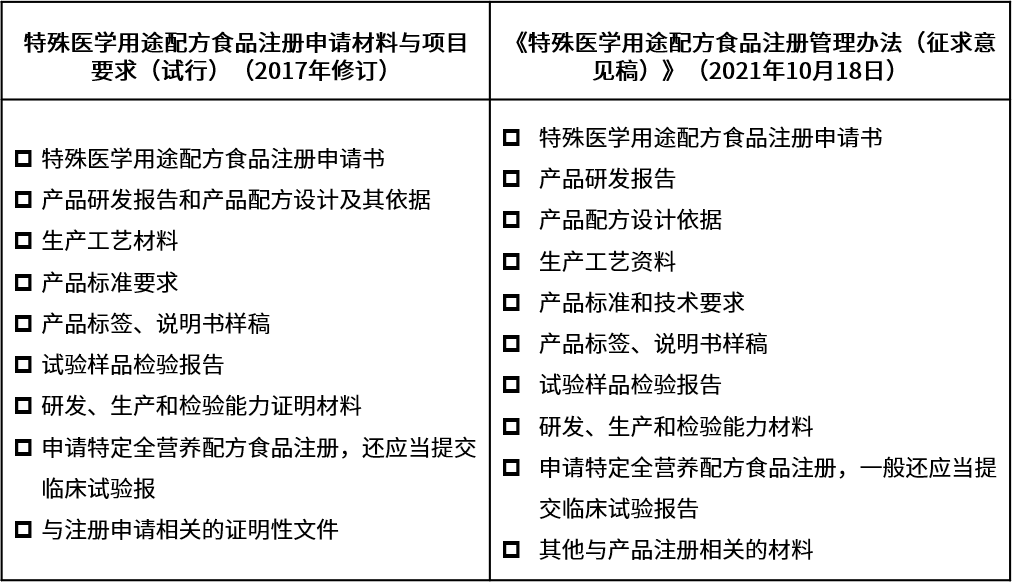
《特殊医学用途配方食品注册申请材料项目与要求(试行)》(2017修订版)
-
《市场监管总局关于调整特殊医学用途配方食品产品通用名称的公告》 2019
-
《特殊医学用途配方食品生产许可审查细则》2019
深蓝海生物医药是新领先在临床 CRO 领域的子品牌,成立于2007年,目前已拥有高专业水准的临床服务团队600余人,已为300余家国内外知名企业提供多元化的研发支持临床技术服务,项目全面覆盖生物药、化药、中药、医疗器械、细胞与基因治疗等药物,满足不同研发型企业的临床研究定制需求,为国内外客户打通新药上市前关键瓶颈。
通过16年经验积累,深蓝海生物医药已经完成临床研究500余项,每年开展Ⅰ类创新药研究10-20项,率先开展医美、特医食品、细胞与基因治疗药物等领域研究,填补国内外多项空白。
依托于新领先CXO服务体系,创建了“交互式”临床服务模式,在项目立项阶段全面介入,做新药创制的全程合作伙伴,整合医学、药政、药学研发等技术专家进行顶层设计,最大限度降低项目研发风险。同时,成立专项政府引导基金,为创新项目提供不同阶段的投融资,最大程度加速药品上市进程。此外,强大的定量药理学及体内外桥接团队针对特定疾病和特定人群进行数字模型研究,制定科学高质的临床研究方案,提高新药临床开发效率。
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
