收藏 | 口溶膜临床研究综述
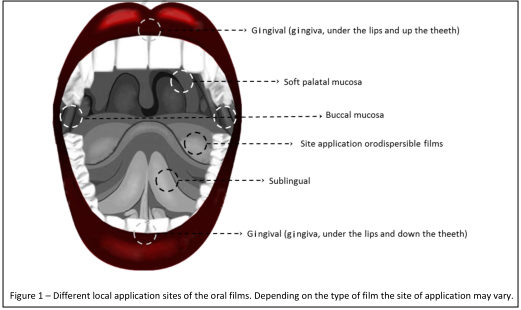
口溶膜作为一种新型口服药物递送剂型,具有可在口腔中迅速崩解,厚度薄,重量轻,耐折抗拉,携带方便,剂量准确等优点,可克服口腔崩解片易碎、抗折性差及口服液体制剂剂量控制差的缺点,有效的解决特殊患者如儿童、老人、精神病患者等服用药物顺应性差的问题,因此受到了广泛关注,是制药企业选择改良创新药物研究的热点剂型。
临床研究是改良创新药研究成功与否的关键,在临床试验开展前利用软件建立药代动力学模型,预测药代动力学参数Cmax,AUC0-t,AUC0-inf,并与参照药进行虚拟生物等效性试验(BE),可有效评估临床研究风险。
药代动力学模型建立需充分理解药物理化性质,剂型释放特点,药物吸收部位等因素。口腔黏膜下有大量的毛细血管汇总到颈内静脉,药物经口腔黏膜吸收后,能避免肝脏首过效应,提高生物利用度,口腔黏膜药代动力学模型的建立首先需理解药物经由口腔黏膜吸收的量。口溶膜剂型的释放特点是在口腔中迅速崩解释放,而口腔腔道中唾液体积小,唾液组成包含钙、钾、钠等离子盐,pH值约为6.8,口溶膜在口腔中崩解后,药物在唾液中存在的形式未知,且口腔黏膜包括颊粘膜、舌下黏膜、硬腭黏膜和牙龈黏膜,不同口腔黏膜之间由于上皮细胞面积、角质层与非角质层组织厚度及组成等生理特征不同,对药物渗透性也不同,其渗透顺序为:舌下黏膜>颊粘膜>硬腭黏膜,药物接触的黏膜类型及接触时间也将影响药物经由口腔黏膜吸收的量,由此口溶膜药代动力学模型的建立面临一定挑战。本文总结了国内外已上市的口溶膜品种的临床研究。
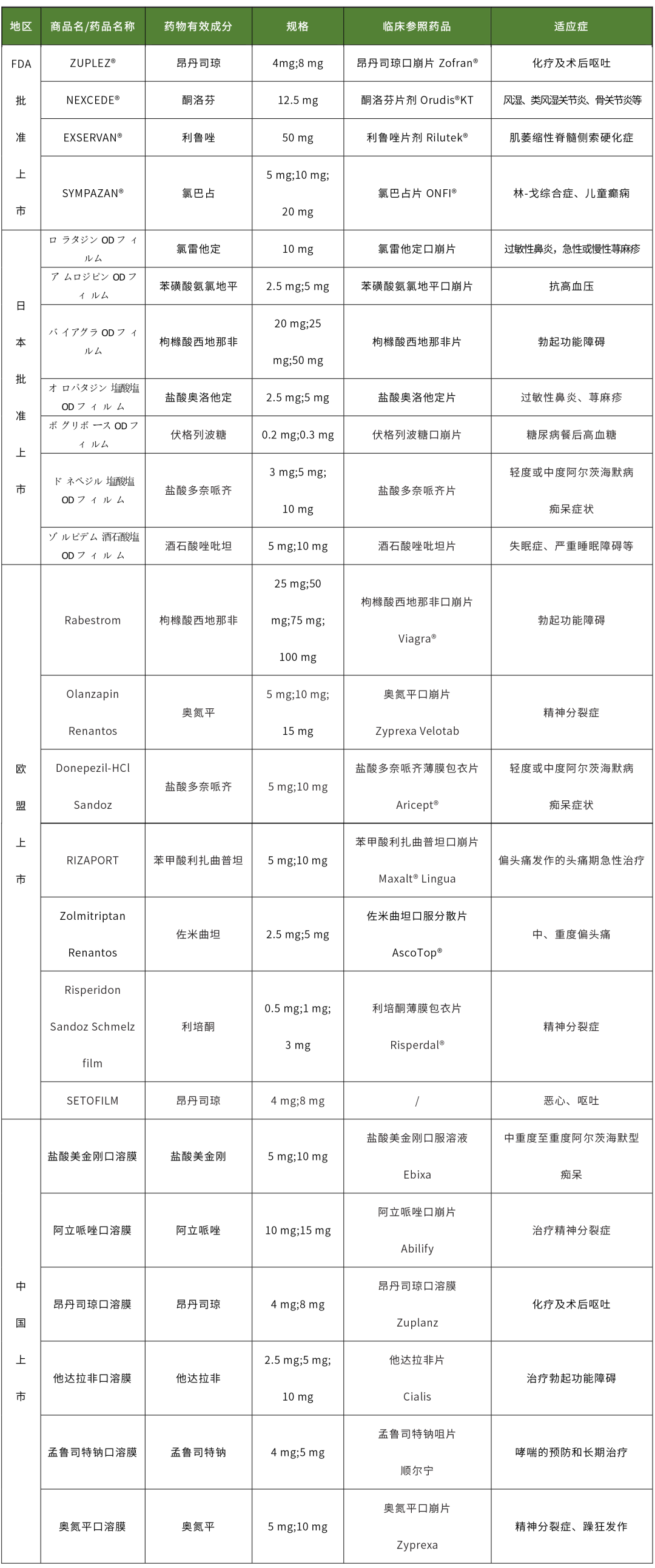
由上表可知,国内外已上市口溶膜的临床参照药剂型大多数都为片剂,其中口崩片居多,薄膜包衣片极少,仅中国上市的盐酸美金刚口溶膜,选择口服溶液作为临床参照药。由剂型释放特点分析,通常情况下薄膜包衣片释放速率慢于口溶膜,口服溶液快于口溶膜,口崩片与口溶膜释放相似,由此选择口崩片作为临床参照药有利于生物等效性研究;但考虑到口溶膜需进行餐后生物等效性研究,不同剂型餐后的胃排空时间不同,与片剂相比口服溶液和口溶膜餐后的胃排空时间相近,因此选择口服溶液作为临床参照药也存在一定优势。
口溶膜厚度薄,重量轻,在口腔中崩解迅速,临床试验受试者在服用吞服过程中敏感度低,存在未吞服或吞服不完全的情况,临床试验设计过程中需关注相关细节的设计,FDA批准上市的昂丹司琼口溶膜在临床研究中比较了其与参照药(口崩片)在口腔中崩解或溶出时间,为临床研究服药吞咽时间制定提供了依据,此外FDA已批准上市的氯巴占口溶膜在临床试验中,要求临床研究人员将膜剂放置在受试者舌头中央,要求受试者用舌头在上颚轻轻摩擦薄膜,以促进薄膜融化和消失。
对于多规格品种FDA、EMA及CDE均可允许基于临床试验规格进行其他规格生物等效性试验的豁免,参考CDE颁布的《以药动学参数为终点评价指标的化学药物仿制人体生物等效性研究技术指导原则》中常释制剂片剂、胶囊剂的多规格生物等性试验要求内容,口溶膜也应需满足各规格制剂在不同pH介质中体外溶出曲线相似及处方比例相似的要求,才能豁免其他规格制剂的生物等性试验。
【参考文献】
[1] European Pharmacopoeia [S]. EP 11.0: 987.
[2] 国家药典委员会. 中华人民共和国药典[S]. 2020年版. 四部. 北京:中国医药科技出版社, 2020:24.
[3] 美国药典[S]. USP 2021: general chapter <1151> PHARMACEUTICAL DOSAGE FROMS.
[4] 江卓芩, 江昌照, 叶金翠, 等. 口腔膜剂的研究进展及市售药物概述[J]. 中国新药杂志, 2020,29(6):634-641.
[5] 陈芳, 夏怡然, 侯惠民. 口腔膜剂的研发及应用[J]. 中国医药工业杂志, 2012,43(6): 484-489.
[6] 陈立, 陈芳. 膜剂的研究和应用进展[J]. 中国医药工业杂志, 2018, 49(5):557-563.
[7] 李丁,王健,侯惠民. 口腔黏膜给药系统研究进展[J]. 中国医药工业杂志, 2009, 40(4):303-307.[8]FDA U.S. Food and Drug Administration. Quality Attribute Considerations for Chewable Tablets Guidance for industry[EB/OL]. https://www.fda.gov/media/98598/download
[9] 谢燕, 袁秀荣, 李国文. 口腔给药系统研究进展及其在中医药中的应用[J]. 上海中医药杂志, 2007, 41(10) :83-86.
[10] Orange Book: Approved Drug Products with Therapeutic Equivalence Evaluations [EB /OL]. [2022-09-28]. https: / /www. accessdata. fda. gov /scripts /cder /ob /.
[11] Pharmaceuticals and Medical Devices Agency[EB /OL].[2022-09-28]. http: / /pmda. go. jp /search_index. Html.
[12] Heads of Medicines Agencies MRI Product Index [EB /OL]. [2022-09-28]. http: / /mri. cts-mrp. eu /Human. Pharmaceuticals and Medical Devices Agencyhttp: / /pmda. go. jp /search_index. Html.
[13] 国家药品监督管理局药品审评中心. [EB /OL]. http://www.chinadrugtrials.org.cn/index.html.
[14] FDA U.S. Food and Drug Administration. Zuplenz (Ondansetron) [EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022524Orig1s000ClinPharmR.pdf
[15] FDA U.S. Food and Drug Administration. Sympazan (Clobazam) [EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/210833Orig1s000ClinPharmR.pdf
[16] 国家药品监督管理局药品审评中心.《以药动学参数为终点评价指标的化学药物仿制人体生物等效性研究技术指导原则》. [EB/OL]. [2016-03-08]. https://www.cde.org.cn/zdyz/downloadAttidCODE=c243e8396e2b86e62de37f3d3e494f2e.
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
