收藏 | 口溶膜处方工艺分析及溶出方法研究
《口溶膜临床研究综述》中总结了国内外已上市的口溶膜品种的临床研究,本篇将针对口溶膜的处方、制备工艺、溶出方法进行总结,同时对口溶膜药代动力学模型的建立提出相关建议。
口溶膜典型处方组成如下:原料药:30%;水溶性成膜聚合物:40-50%;增塑剂:0-20%;填充剂、色素、矫味剂等等:0-40%。
原料药:原料药的粒径或粒度分布及晶型的质量属性将对制剂溶出速率造成影响,此外在口溶膜制备过程中,由于原料药溶解性质可能会发生重结晶现象,制备过程中原料药晶型检测也非常重要。
水溶性成膜聚合物:水溶性成膜聚合物的性质将影响制剂的粘附性、崩解时限、载药量及机械性能等质量特性,其材料性质的理解,有助于分析口溶膜剂型释放特性,建立更具预测性药代动力学模型。
目前在口溶膜处方中广泛使用的水溶性成膜聚合物包括:纤维素类、淀粉类、半合成、合成的成膜聚合物等,其特性如下表所示:
水溶性成膜聚合物特性
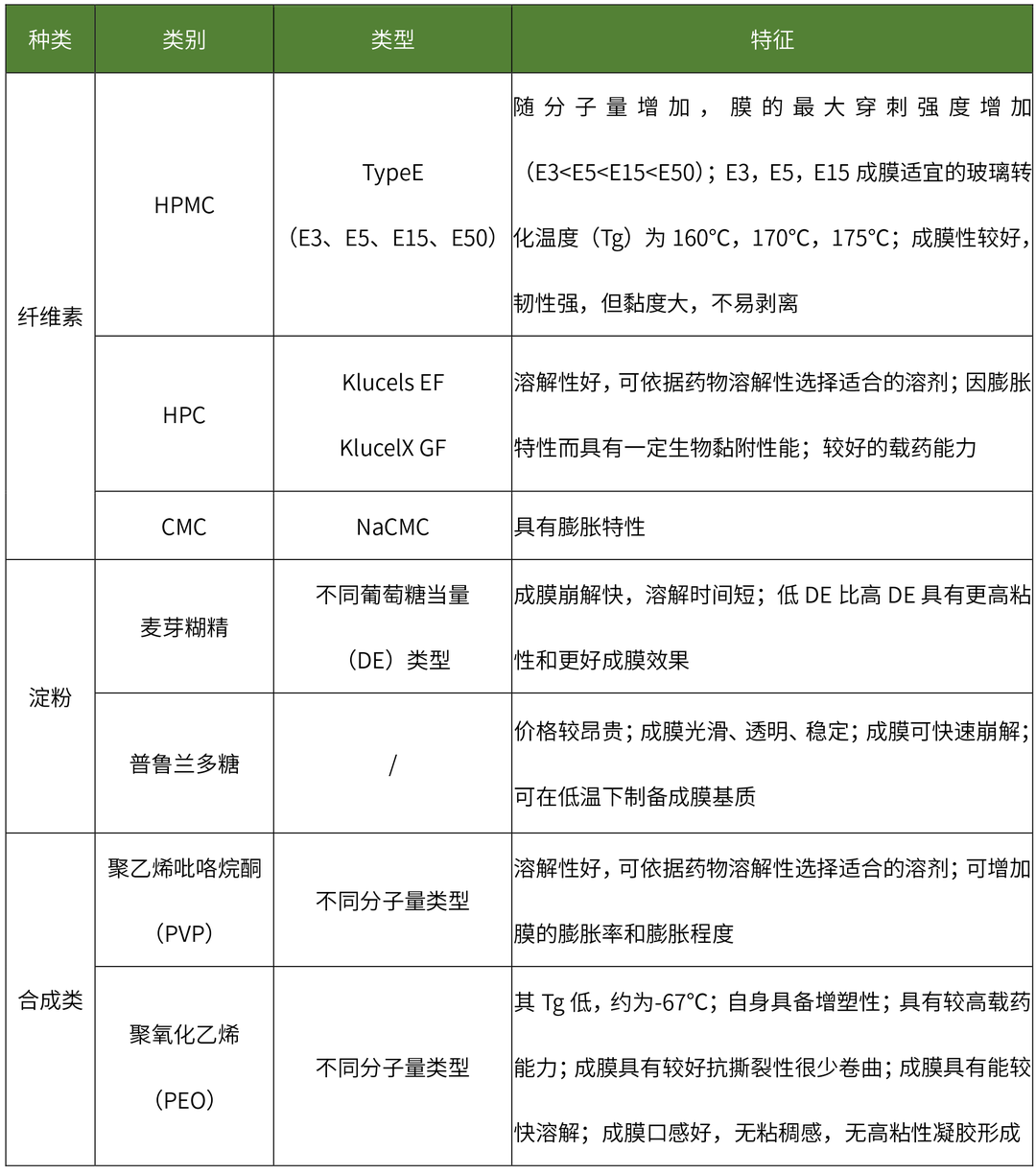
(点击查看大图)
不同类型成膜材料或不同比例成膜材料制备的口溶膜具有不同的释放速率,利用药代动力学模型对不同释放速率的口溶膜进行药代动力学参数进行分析,可更清晰理解成膜材料对体内外释放影响的相关性。
增塑剂:增塑剂可与水溶性成膜聚合物相互作用,有利于膜剂的分装和切割。常用的增塑剂有甘油、聚乙二醇(PEG400)、山梨醇、丙二醇等。有文献报道增塑剂可能影响原料药溶解度和药物的吸收, 因此在处方研究也需关注增塑剂种类及用量的研究。
填充剂、色素、矫味剂等其他辅料:口溶膜口感是影响临床受试者脱落的关键因素,也是口溶膜的关键质量属性之一,甜味剂时常被用作膜剂中起矫味作用,经常被使用的甜味剂包括蔗糖、葡萄糖、糖精钠、阿斯巴甜、三氯蔗糖等,其中三氯蔗糖由于其甜度高、安全性高、能量低,在各国的上市品种都包含;部分品种也会采用离子交换树脂等掩味技术,掩盖药物苦味。 由于原料药本身特性,如溶解性较差,稳定性不好,选择在处方中添加表面活性剂或制备成纳米混悬剂、环糊精包裹改善溶解性,或添加稳定剂改善品种稳定剂,改善原料药溶解性辅料将极有可能影响药物生物利用度,若临床对照药未采用相关辅料,则应谨慎选择。
二、口溶膜工艺
膜剂的制备工艺包括传统的溶剂浇铸法和热熔挤出法,也可应用新型的3D打印技术。
溶剂浇铸法:溶剂浇铸法是最常被运用的制备技术,其工艺过程简单概况而言就是将成膜材料、原料药和其他辅料溶解或悬浮在适宜的溶剂中,如水、乙醇、丙酮等;混合均匀后去除气泡,然后浇铸到模具上或涂布成膜剂,干燥后进行切割和包装。
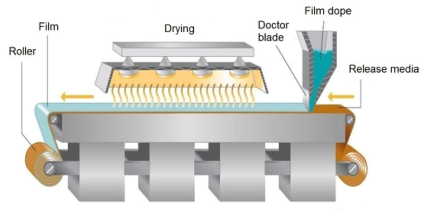
▲ 溶剂浇铸法

▲ 涂布机
如果浇铸混合溶液为混悬液或乳液,浇铸过程中需关注其均匀性。分散颗粒大小不宜过大,如果颗粒粒径大于250 μm,在工艺过程中可能会发生沉积,在膜表面形成划痕。
干燥过程中需避免溶剂蒸发后在浇铸溶液表面形成薄膜,阻碍溶剂的继续蒸发,升高干燥温度可使薄膜破裂,但反复形成薄膜后再破坏,将使最终形成的膜剂表面不均匀;干燥终点控制也非常重要,有机溶剂残留量需控制在可接受限度内,水分残留量可能会影响到膜剂的机械性能和稳定性。
热熔挤出法:熔挤出法主要是难溶性药物的膜制备技术,是将药物、成膜材料及其他辅料混合物熔融挤压通过模具,压成膜,冷却后切割,包装。
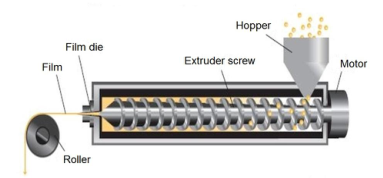
▲ 热熔挤出法

▲ 热熔挤出机
热熔挤出工艺过程中可能出现挤出物膨胀现象,主要是由于成膜聚合物粘弹特性,在挤压过程中受到高剪切和高能捏合导致,将影响最终膜剂的尺寸,可通过工艺参数调节解决该问题。
热熔挤出工艺过程中原料药在高温、残留水及残留溶剂的作用下发生水解等化学反应,将影响最终膜剂的质量控制和稳定性;残留水及残留溶剂可通过辅料预处理尽可能控制,原料药则需对热稳定。
在高温、压力和强力混合下可能增加混合物中原料药的溶解度,但温度降低后,混合物中的原料药可能会发生重结晶现象,可能影响最终膜剂的溶出,可选择高粘度成膜材料解决。
打印技术:3D打印技术是将处方混合配制成打印浆液,通过计算机打印软件导入口溶膜的三维模型,设置印刷参数进行打印制备,可以灵活的设计和准确的打印剂量为口溶膜个性化给药提供一种新型制备方式;但3D打印技术需要选择合适的打印基质,且载药量较低,制备技术目前运用较少。
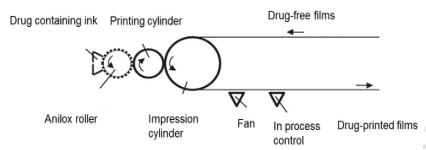
▲ 打印技术
溶出方法分析
目前国内外已上市口溶膜品种大多数溶出方法为桨法,溶出介质为水,介质体积为900 mL,未考虑舌的机械力,唾液流速,唾液体积小和唾液成分等口腔溶出的生理条件,此外口溶膜一般较轻,投到溶出介质中,极易漂浮在溶出介质表面影响溶出结果。
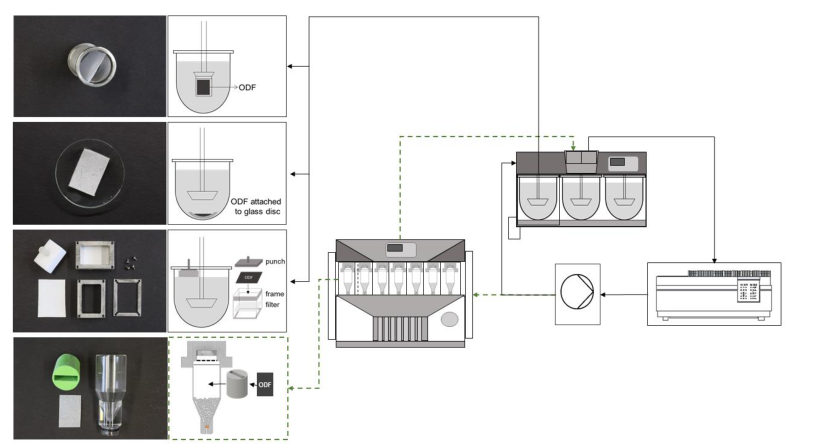
▲ 溶出方法
有文献开发设计了更具有区分力的口溶膜溶出方法如:
由于口溶膜剂型特征为崩解迅速,厚度薄,重量轻,并且口腔中唾液体积小、唾液成分复杂,体内外相关性溶出方法建立困难,目前文献报道区分溶出方法,尚未有校验标准,不同设备之间检测结果存在差异,无法判定方法的适宜性,未来仍需摸索建立口溶膜生物相关性溶出方法。
总结
通过对口腔生理条件以及口溶膜临床研究、处方工艺、溶出方法的总结分析,口溶膜药代动力学模型建立可能存在问题包括:
-
无法确认药物在口腔中吸收的量;
-
影响药物理化性质及制剂释放特性的处方工艺因素较多;
-
体内外相关性溶出方法建立困难。
吡罗昔康原料药溶解性较差,在pH1.8~pH5.4之间溶解度最低,且具有多晶型,不同晶型间的溶解性不同,口溶膜处方中成膜材料、pH调节剂、表面活性剂等均会影响吡罗昔康溶解性;Ahmed Abd EI-Bary等人[30]在建立吡罗昔康口溶膜药代动力学模型时,为充分理解制剂释放特性,除了溶出曲线的研究,还检测了膜剂微环境的pH值,并采用光学显微镜和电子扫描显微镜,确定原料药的粒径以及在膜剂中分布的形态,通过药代动力学模型的虚拟生物等效性试验,确定了吡罗昔康口溶膜的最优处方。
在Fang chen等人的利培酮口溶膜PBPK药代动力学模型的建立过程中发现利培酮口溶膜在水介质15min的溶出量是控制生物等效性风险的关键质量属性。
药代动力学模型的建立可有效提升制剂开发效率,降低临床研究的风险,由于口溶膜剂型特征以及口腔中生理条件的特性,口溶膜药代动力学模型建立面临一定挑战,在吡罗昔康口溶膜和利培酮口溶膜药代动力学模型建立的文献中可知,对药物理化性质、剂型释放特性的理解是建立符合预期药代动力学模型的前提,虽然目前对口溶膜处方工艺的了解已较为充分,但影响药物理化性质及制剂释放特性的处方工艺因素仍需开发适宜的方法进行判定,且尚未有成熟的口溶膜生物相关性溶出方法,该方向的研究发展将极大提升口溶膜药代动力模型预测的准确性,此外还需关注药物在口腔中释放吸收的量。
【参考文献】
[1] ARUN A, AMRISH C, VIJAY S. Fast Dissolving Oral Films: An Innovative Drug Delivery System and Dosage Form [J]. Int. J. Chem Tech.2010,2(1):576-583.
[2] SIMON G, AMIT V, MARK S. Monitoring crystallisation of drugs from fast-dissolving oral films with isothermal calorimetry [J]. Int. J. Pharm. 2009.380 :105-111.
[3] ANA F B , CLAUDIA S , JORGE F J. Current status and future perspectives [J]. J. Control. Release. 2015, 206(28):1-19.
[4] 陈立, 王兵, 杨柳榴, 等. 奥氮平口溶膜的制备和体内外评价. [J]. 中国医药工业杂志, 2019,50( 7): 762-772.
[5] 张桦, 王栋海, 等. 利培酮口腔膜的制备及体内外评价[J].中国医药工业杂志, 2017,48( 3): 406-412.
[6] 朱丽丹,张丽妍.盐酸氟西汀口溶膜的制备与质量评价[J].西北药学志, 2020,35(6):889-893.
[7] 任连杰, 刘娟, 马骏威等. 口腔膜剂的研发与评价[J]. 中国中药杂志, 2017,42(19) : 3696-3702.
[8] SCOTT M. HARDIK V. MENG L, et al. Critical material attributes (CMAs) of strip films loaded with poorly watersoluble drug nanoparticles: I. Impact of plasticizer on film properties anddissolution[J]. Eur. J. Pharm. Sci. 2016,92(20):146-155.
[9] 陈芳, 张桦, 周臻, 等. 氢溴酸右美沙芬口溶膜的制备及体内外评价, 中国医药工业杂志, 2015, 46(9):964-969.
[10] 沈英, 黄雅菲, 俞平, 等. 阿立哌唑纳米混悬剂口溶膜的制备与质量评价[J]. 西北药学杂志, 2020,35(4):549-553.
[11] 张明会, 张勇, 王栋海, 等. 一种稳定的孟鲁司特口腔薄膜剂. 中国, 104784157A [P]. 2015-07-22.
[12] BARNHART S, SLOBODA M. The future of dissolvable films [J]. Drug Deliv Technol. 2007,7(8):34-7.
[13] GOEL H, RAI P, RANA V, et al. Orally disintegrating systems: innovations in formulation and technology [J]. Recent Pat Drug Deliv Formul. 2008,2(3):258-74.
[14] RUSHIRAJ J, DASHARATH P. Hot melt extrusion: An industrially feasible approach for casting orodispersible film [J]. Asian J Pharm Sci, 2015, 10(4)292-305.
[15] 闫廷廷, 吕竹芬, 林威, 等. 半固态微挤出3D打印技术运用于个性化定制口腔速溶膜[J]. 中国新药杂志, 2020,29( 8): 946-952.
[16] RAPHAEL K, DANIEL S, MIRIAM P, et al. A new biorelevant dissolution method for orodispersible films [J]. Eur. J. Pharm. Biopharm.2016,98:20-25.
[17] Yiran Xia, Fang Chen, Huiping Zhang, et al. A new method for evaluating the dissolution of orodispersible films [J]. Pharm. Dev. Technol.2015.20(3):375-379.
[18] Ahmed Abd El-Bary, Ibranhim Al Sharabi , Balqees Saeed Hzaz’a. Effect of casting solvent, film forming agent and solubilizer on orodispersible films of a polymorphic poorly soluble drug: An in vitro/in silico study [J]. Drug Dev.ind.Pharm. 2019,45(11):1751-1769.
[19] Fang Chen, Hongrui Liu, Bing Wang, et al. Evaluation of the Impacts of Formulation Parameters on the Pharmacokinetics and Bioequivalence of Risperidone Orodispersible Film: a Physiologically Based Pharmacokinetic Modeling Approach. AAPS Pharm Sci Tech. 2020,21(7),245.
-END-


转载声明:未经本网或本网权利人授权,不得转载、摘编或利用其他方式使用上述作品。已经本网或本网权利人授权使用作品的,应在授权范围内使用,并注明“来源:新领先医药科技”。

 Hotline服务热线:010-61006450
Hotline服务热线:010-61006450
 简体中文
简体中文

 010-61006450
010-61006450 联系地址:
联系地址: 技术市场部:
技术市场部: 北京新领先
北京新领先 新领先药讯
新领先药讯 010-61006450
010-61006450
